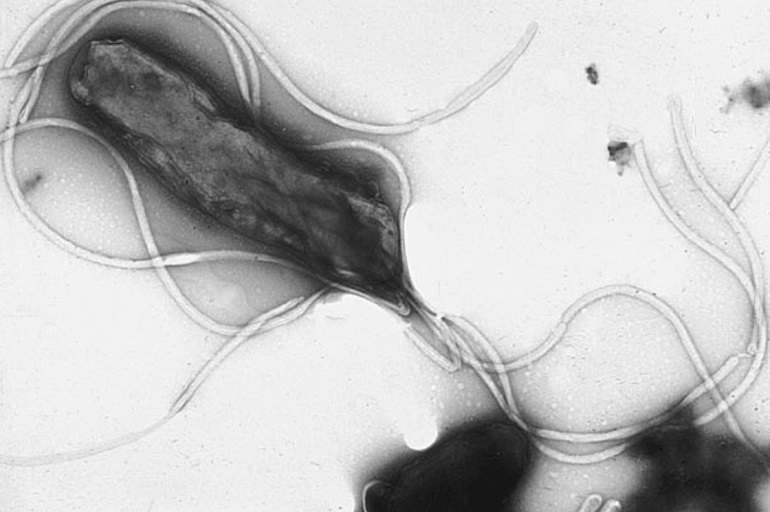
El descubrimiento de Helicobacter pylori en 1979 y posterior aislamiento, valió el Nobel en 2005 a los australianos Robin Warren y Barry Marshall, el primero en observar bacterias asociadas a biopsias de estómago de pacientes con gastritis crónica, y a su discípulo, experto en medicina clínica, que la identificó.
Marshall, para demostrar que H. pylori era la causante de la gastritis y las úlceras, y que estas podían tratarse con antibióticos, ingirió la bacteria extraída de un paciente. Posteriormente desarrolló gastritis, pero logró curarse con antibióticos, desmintiendo así la creencia de que el estrés era la principal causa. Gracias a su descubrimiento, muchas personas pudieron superar dolencias gástricas que, hasta entonces, carecían de tratamiento eficaz.
En la actualidad, en España una de cada dos personas podría estar infectado por H. pylori, “Tal vez algo menos, un 40 %, porque los datos del 50 % son de hace diez años” y se supone que habrá bajado por la detección y tratamiento, matiza Javier Gisbert, del Servicio de Aparato Digestivo del Hospital Universitario La Princesa y del Centro de Investigación biomédica en red de enfermedades hepáticas y digestivas (CIBERehd).
En cualquier caso, se trata de la infección más frecuente del planeta, junto con la caries dental, apunta Gisbert, que participó como coordinador de Tratamiento en la última edición de la Guía de consenso sobre H. Pylori de Maastricht/Florencia publicada en 2022 en GUT, revista internacional líder en gastroenterología.
Una intensa investigación
Desde el descubrimiento de H. pylori, la investigación ha sido intensa y los detalles sobre los mecanismos patogénicos de esta bacteria se están actualizando continuamente. De ahí la importancia de las guías de consenso sobre el manejo de esta infección y del Registro Europeo del Manejo de Helicobacter pylori, que a todos los efectos es mundial, del que Gisbert es también uno de los coordinadores. “Incluye casi 80.000 pacientes y cada año se añaden en torno a 10.000”, añade.
Además, existen consensos específicos para cada país, “con matices en función de las tasas de resistencia antibióticas o diferente disponibilidad de fármacos. El español se publicó hace un par de años”.
Estos registros tienen una “rentabilidad tremenda para los pacientes porque generan una cantidad de información, fundamental para guiar el manejo de la infección y generar conocimiento sobre la bacteria”, destaca Gisbert.
“Es curioso que aún no sepamos con certeza cómo se produce el contagio”, señala Gisbert. Todo apunta a una doble vía. En los países con peores condiciones higiénicas probablemente la transmisión sea fecal-oral, a través de las heces y aguas contaminadas.
En los países desarrollados predomina la vía oral-oral. “Por aclararlo, no se contagia ni por saliva ni por besos; sino por vía gastro-oral (vómitos o regurgitaciones del contenido del estómago). Los niños, que vomitan con frecuencia, si están infectados pueden transmitirla de este modo a los adultos”, explica.
Doble defensa
Aunque afecta a unos 3.500 millones de personas en todo el mundo, “la mayoría de los infectados (el 90 %) no se va a enterar que tienen H. pylori, explica el doctor Blas Gómez Rodríguez, coordinador andaluz del Registro Europeo de H. pylori y médico especialista del servicio de aparato digestivo del Hospital Universitario Virgen de Macarena, de Sevilla.
Antes de su descubrimiento se pensaba que el estómago era un órgano estéril, debido al ácido clorhídrico que liberan las glándulas de la pared gástrica para ayuda a digerir los alimentos, y que se suponía que impedía el crecimiento de patógenos.
Sin embargo, H. Pylori se ha adaptado a ese ambiente hostil, refugiándose en la capa de moco que recubre las paredes del estómago para defenderle del ácido clorhídrico. “Una enzima llamada ureasa permite a la bacteria sobrevivir” neutralizando localmente la acidez del estómago, aclara Gómez Rodríguez.
Además, Helicobacter utiliza otra estrategia: penetra en la mucosa y se une a las células que revisten el interior del estómago, y así evita que el sistema inmunitario la reconozca y la destruya.
Detección y tratamiento
Ante la presencia continuada de molestias estomacales o malas digestiones (dispepsia), se utilizan dos pruebas no invasivas para detectar a la bacteria: la prueba de aliento y el test de antígenos en heces.
Confirmada la presencia, se erradica con una mezcla de antibióticos (para esquivar la resistencia que está aumentando) junto con una alta dosis de inhibidores de la bomba de protones (omeprazol o derivados), con una duración entre 10 y 14 días. Los inhibidores de la bomba de protones son una parte fundamental del tratamiento, porque al disminuir la acidez del estómago hace más vulnerable a la bacteria. Se utilizan 3 antibióticos más omeprazol, o, como alternativa, dos antibióticos más omeprazol y bismuto, que tiene propiedades antibacterianas y no genera resistencia.
Según los consensos clínicos sobre H. pylori, se considera que una terapia es óptima cuando alcanza una tasa de erradicación del 90%. Ninguna supera esa tasa por aumento de las resistencias de H. pylori a los antibióticos.
El factor que más influye en la eficacia del tratamiento es precisamente su cumplimiento, por ello Gisbert recomienda invertir tiempo en explicar muy bien al paciente los efectos secundarios del tratamiento, que los hay, y enfatizar, “que debe tener paciencia y resistir porque después desaparecen”.
Un mes después de concluido el tratamiento, hay que repetir el test para confirmar que la infección ha desaparecido. Pero superar la infección no confiere inmunidad, advierte el Dr. Gómez: “Si hay un foco de infección cercano te vuelves a contagiar”.
El genoma de Helicobacter pylori
Gisbert participa en un proyecto multicéntrico en el que se han recogido muestras de tejido gástrico en más de 50 países para obtener tener la trazabilidad de la bacteria: “Aunque convive con nosotros más de 100.000 años y está distribuida por todo el mundo, desconocemos de dónde proviene, cuáles son sus ancestros y cómo se han ido infectando las distintas poblaciones”, apunta.
El estudio del genoma es fundamental porque permite esta trazabilidad genómica. Además, la patogenicidad de Helicobacter varía: algunas cepas son más virulentas que otras. Incluso el mismo Helicobacter en unos casos puede producir lesiones más importantes y en otros puede ser un colonizador pacífico del estómago.
En cualquier caso, advierten los expertos, no existe el estado de portador sano. La gastritis se produce siempre por la presencia de Helicobacter, que pueden derivar en lesiones más importantes, como una úlcera o en algunos casos cáncer gástrico, asociadas muy estrechamente a la infección por Helicobacter, en función de la virulencia de la bacteria y de la genética del paciente, que puede tener cierta predisposición.
Entre los últimos estudios, uno se centra en una de las variantes más agresivas de la Helicobacter, la cepa USU101, y abre nuevas vías para el estudio del cáncer gástrico.
Los investigadores aislaron dos toxinas CagA y VacA. Y vieron que la primera está involucrada en la inflamación y la progresión de la enfermedad, mientras VacA favorece la colonización de la mucosa gástrica, explica desde el grupo de investigación de Infecciones comunitarias del Instituto Park Taulí de Barcelona.
Fuente: SINC
artículo original de: https://www.saludadiario.es/salud-publica/helicobacter-pylori-la-infeccion-silenciosa-que-causa-gastritis-ulceras-y-cancer/